FDA Approval
- Zion corporate logo symbol シオン企業のシンボル
- 悪魔の新世界秩序の思考
- ワクチンは人の遺伝子を汚染する
- World of 666
- MSDメルクに666のコード
- ハイテク優生学
- ワクチンマフィア
ワクチン秘密のコード”666”
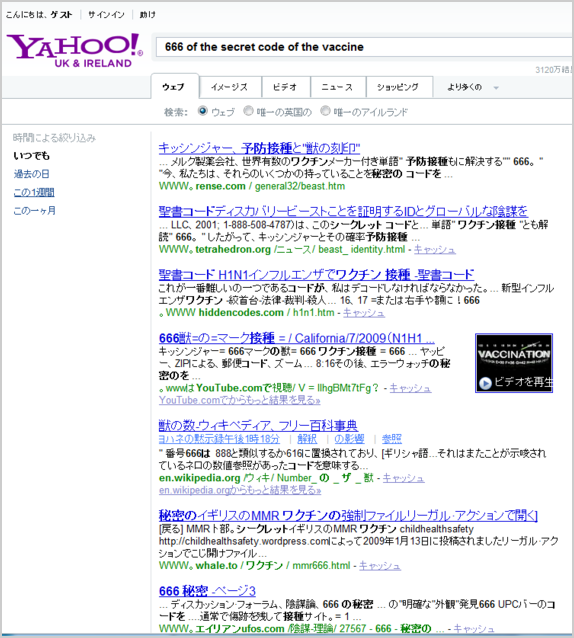
666 of the secret code of the vaccine
Gardasil 6/6/2006
シオニストはここまでこだわっていた!
次のように我々は、2006年6月6日の提出で説明されている市販後臨床約束を認める。
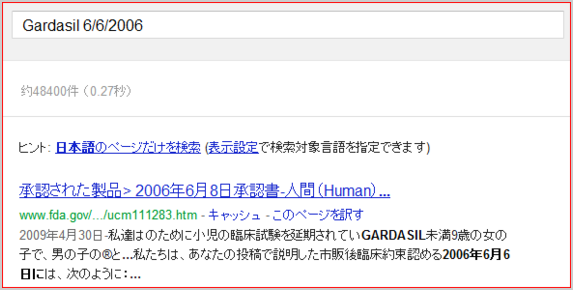
We acknowledge the postmarketing clinical commitments outlined in your submission of June 6, 2006, as follows:

Cervarix 666 サーバリックス666の刻印
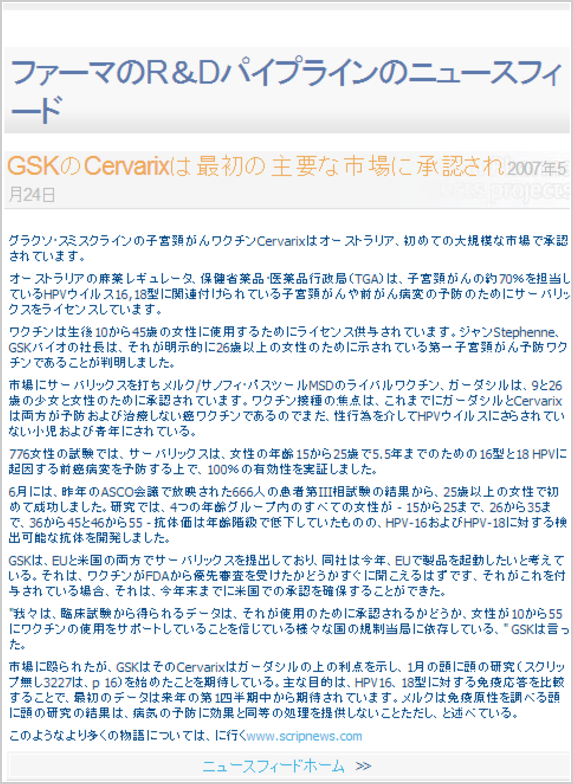
Results from a 666-patient Phase III study aired at last year's ASCO meeting in June were the first in women over the age of 25. In the study, all women in four age groups - 15-25, 26-35, 36-45 and 46-55 - developed detectable antibodies against HPV-16 and HPV-18, although antibody titres were lower in the older age groups.
http://www.pharmaprojects.com/news/2405_1116.htm
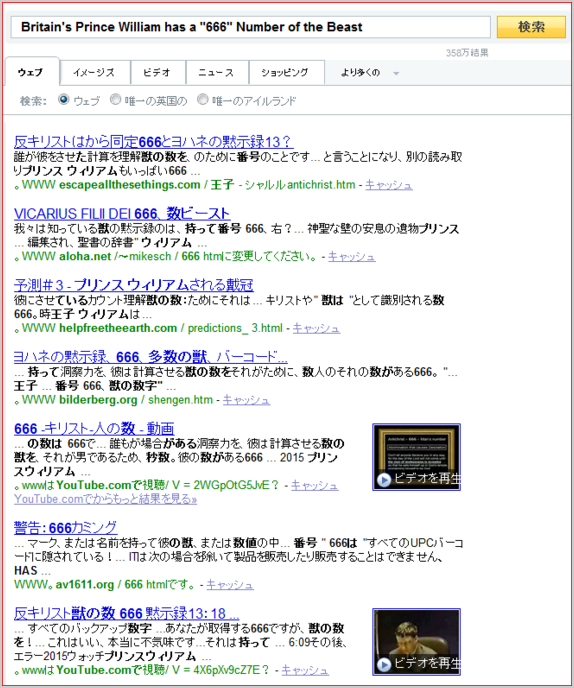
英国のウィリアム王子は獣の"666"番号が付いている
Britain's Prince William has a "666" Number of the Beast
June 8, 2006 Approval Letter - Human Papillomavirus Quadrivalent (Types 6, 11, 16, 18) Vaccine, Recombinant

-
グーグルで読む
ワクチン、血液および生物学的製剤
ホーム ワクチン、血液および生物学的製剤 ワクチン 承認された製品
ワクチン
承認された製品 2006年6月8日承認の手紙 - 4価ヒトパピローマウイルス(タイプ6、11、16、18)組み換えワクチン
保健社会福祉省
公衆衛生局の
食品医薬品局(FDA)
1401ロックビルパイク
ロックヴィル、メリーランド州20852から1448
2006年6月8日
私たちのSTN:BL 125126/0
メルク株式会社
担当:博士パトリックブリル·エドワーズ
監督
世界の薬事
ワクチン/バイオ
私書箱4、BLB-22
ウエストポイント、PA 19486から0004
博士はブリル·エドワーズ親愛なる:
我々は、4価ヒトパピローマウイルス(タイプ6、11、1 6、18)組換えワクチンは、この日のために効果的な生物学的製剤のライセンスアプリケーション(BLA)を承認しています。あなたは、ここに紹介したり、州際通商、4価ヒトパピローマウイルス(タイプ6、11、16、18)保健福祉サービスの米国ライセンス番号0002の既存の部門の下に遺伝子組換えワクチンへの導入のために提供することが許可されています。四価ヒトパピローマウイルス(タイプ6、11、16、18)組換えワクチンは、ヒトパピローマウイルス(HPV)のタイプ6、11、16、18に起因する以下の疾患の予防のための女性の年齢9から26年の予防接種のために示されています。
子宮頸癌
生殖器疣贅(尖圭コンジローマ)
、次の前癌性または異形成病変:
子宮頸部腺癌上皮内(AIS)
子宮頸部上皮内腫瘍(CIN)グレード2とグレード3
外陰部上皮内腫瘍(VIN)グレード2とグレード3
膣上皮内腫瘍(VAIN)グレード2とグレード3
子宮頸部上皮内腫瘍(CIN)グレード1。
この承認の下で、あなたは4価ヒトパピローマウイルス(タイプ6、11、16、18)メルク社、ウェストポイント、PAでの組換えワクチンを製造することが承認されています。最終製剤と充填は、メルク社、ウェストポイント、PAによって実行されます。
ラベリングと包装は、メルク社、ウェストポイント、PAによって行われます。あなたは、独自の名前GARDASIL®を使用して製品にラベルを付けることができます。ワクチンは、0.5 mLを単回投与バイアル、10 0.5mLの単回投与バイアルのカートン、0.5 mLを単回投与充填済み注射器と6 0.5 mLを単回投与充填済み注射器のカートンとして供給されます。プレフィルドシリンジは、超安全®パッシブ™ニードルガード装置と組み立て済みになります。
2から8℃で保存した場合、GARDASIL®のワクチンのデート期間は、最終的な充填容器の製造日から36ヶ月でなければならない 36ヶ月の貯蔵寿命は、最終的な充填した容器が2〜8°Cパッケージングの前にで開催されている時間のすべてが含まれています。製造年月日は、最終的な容器に充填の開始日として定義されなければならない。
該当するすべてのテストの結果を示す電子形式でのロットリリースプロトコルと一緒に製品の最終バルクサンプルと最終容器のサンプルを提出してください。あなたが監督、生物学的製剤評価研究センター(CBER)からのリリースの通知を受信するまでは、製品のいずれかの多くを配布することはできません。
あなたは私たちのレビューとGARDASIL®のワクチンの製造、テスト、パッケージングやラベリング、または製造施設の変更のために、21 CFR 601.12の下で書かれた承認のためにあなたのBLAに情報を提出しなければなりません。
小児研究エクイティ法(PREA)の下、新たな有効成分、新剤形、新しい適応症、投与の新しいルート、新しい投与レジメンのすべてのアプリケーションは、小児患者では、製品の安全性と有効性の評価が含まれている必要がありますこの要件は免除または延期されていない限り。我々は、年齢未満の9歳の女の子でGARDASIL®の小児の臨床試験を延期すると少年と青年期の男性の年齢18歳未満にされています。
21 CFR 601.70の要件を報告の対象と市販後研究。
次のように我々は、2006年6月6日の提出で説明されている市販後臨床約束を認める。
あなたは、米国のマネージドケア組織(MCO)の短期的な安全監視調査を実施することを約束しています。研究では、一般的な短期の安全性(すなわち、緊急治療室の訪問、入院、死亡)を評価するための60日間続きます約44,000予防接種対象者が含まれます。
被験者はまた、新たな自己免疫疾患、リウマチ性条件、または甲状腺炎の予防接種に続いて6ヶ月間続きます。また、子供の年齢11-12歳、十分な数の安全性の結果の分析を可能にするために検討される。最終的な試験プロトコルは、2006年12月31日が提出されます。患者の発生は、2008年12月31日までに完了されます。
研究は2009年6月30日までに完了されます。最終的な調査報告書は2009年9月30日が提出されます。
あなたがGARDASI®の投与後の長期転帰を評価するために、北欧地域の4カ国(スウェーデン、ノルウェー、アイスランド、デンマーク)のがん登録とのコラボレーションすることを約束しています。本研究では、プロトコル015(まもなく承認後に予防接種をされているでしょうプラセボ群から半分)に在籍する約5,500の被験者は14歳の合計が続きます。
本研究の二つの主要な目標は以下の通りです:1)CIN 2/3、AIS、子宮頸がんのHPV 6/11/16/18-related入射画期的な例が存在するために生検標本を評価することにより、GARDASIL®の長期的な有効性を評価する(VIN)2/3、外陰癌、および無駄な2/3、膣がん、GARDASIL®の投与は、非ワクチンHPV型に起因する疾患のワクチンHPV型に起因するこれらの疾患の交換になりますかどうかを評価する、2)。本研究では、2006年6月6日には、BLAの提出で説明したように、これらの目標を達成するために設計されています。
この研究の最終的なプロトコルは、2006年12月8日が提出されます。本研究の患者発生は、以前のプロトコル015のコンテキスト内で完成しました。本研究では、2017年12月31日、(北欧4カ国でプロトコル015に在籍最後の患者の開始から14年)によって完成されます。最終的な調査報告書は2018年12月31日が提出されます。
あなたは、GARDASIL®は、欧州連合(EU)で承認され、ノルウェー政府がノルウェーで次のようにHPVワクチン接種の影響を評価するためには、その国のガイドラインにHPVワクチン接種を搭載している場合は、ノルウェー政府と共同で研究を行うことを約束しています:
HPV 6/11/16/18-related頚部疾患の発生率を含むHPV疾患の長期的負担。
HPV 6/11/16/18以外のタイプのHPVによって引き起こされる疾患の長期的負担。
子宮頸部HPV疾患の全体の発生率。
HPV関連癌の発生率は、事前に癌(CIN 2/3、AIS、子宮頸がん、VIN 2/3、外陰癌、および2月3日VAINおよび膣癌);
GARDASIL®および医療誕生レジストリで予防接種レジストリをリンクさせることにより、妊娠の結果、特に先天異常の投与の間の相互作用。
研究人口の大きさと年齢範囲は、ノルウェー政府が実施し、最終的なワクチン接種のガイドラインに依存します。この時点では北欧地域内の他の政府が同様の人口調査にコミットしなかったが、それらが発生した場合は、他のコラボレーションのCBERに通知します。
最終的な治験実施計画書の提出の投影日は、上述したようにノルウェー政府との連携を保留されています。患者の発生は、6年の研究開始後に完了する予定です。研究では、7年の研究開始後に完了する予定です。最終調査報告書は、8年の研究開始後に送信されます。GARDASIL®の承認がノルウェーで発生しないことをイベントでは、CBERに通知し、適時に、この情報を取得するために代替的なアプローチをご提案します。
あなたは、完成したときにプロトコル013と015の最終的な臨床試験報告書(CSRの)を提出することを約束しています。として説明したように、これらの研究は、 "すべてのCIN 2/3、AISまたは子宮頸がん"の分析は、非ワクチンHPV型と16型および18、HPVに起因する疾患の交換のための証拠を評価します。
同様の分析は、VIN 2/3、VAIN 2月3日、外陰癌と膣癌のために行われます。プロトコル013 2001年12月に提出された、プロトコル015、2002年5月に提出されました。プロトコル013発生は2003年3月に完成し、プロトコル015発生は、2003年5月に完成しました。これらの分析は2007年4月30日までに完了されます。これらの分析結果を含むようにこれらの研究の最終報告書(すなわち、CSRは)2007年6月30日が提出されます。
あなたは、GARDASIL®の免疫後に投与期間に関するデータは、前述したように研究から次のように提供することを約束しています:
北欧の長期フォローアップ研究:
効果の中間報告(すなわち、CIN 2/3、AIS、子宮頸がんの入射画期的なケース、VIN 2/3、外陰癌、および2月3日VAINおよび膣がん)と免疫原性結果は2009年、2011年、2013年と2015年に提出される。最終的な調査報告書は2018年12月31日が提出されます。
プロトコル018(思春期センチネルコホート):
月24免疫原性と長期安全性データから始まる定期的なレポートは、遅くとも2007年3月30日より開始しません送信されます。
1年間投与後3データの公表は2007年1月30日が提出されます。
1.5年後の用量の3つのデータのための生物学的製剤のライセンスサプリメント(BLS)は、2007年6月30日が提出されます。
2.5年間投与後3データのための生物学的製剤のライセンスサプリメント(BLS)は、2007年12月31日が提出されます。
5.5年間投与後3データのための生物学的製剤のライセンスサプリメント(BLS)は、2010年12月31日が提出されます。
プロトコル007:
5年間の免疫原性データの公開は2006年12月31日が提出されます。
プロトコル005:7の公開と1年半の免疫原性のデータは2007年12月31日が提出されます。
あなたが前向きに妊娠中のGARDASIL®に自発的に報告されたエクスポージャーに関するデータを収集するために、米国で妊娠のレジストリを確立することに合意しました。
あなたは2006年7月20日に米国の妊娠レジストリのプロトコルを提出することを約束しています。あなたは、FDAの妊娠露出レジストリを確立する上で業界のためのガイダンス(2002年9月2日)(http://www.fda.gov/cber/gdlns/pregexp.htm)、ならびに関連会社の標準で検出された要素に対処することで合意しました操作手順。さらに、あなたは、このガイダンスからの重要な逸脱のCBERに通知し、そして/または、プロトコルでの偏差を指定すると述べている。
患者発生/データ収集プロトコルのCBERの承認の時点で開始し、5年後に終了します。あなたは5年間の患者発生/データ収集の開始後に年次報告書および米国の妊娠のレジストリの調査結果の最終的な要約レポートを提出する。アメリカの妊娠·データベースは、5年間の最後のサマリー·レポートを準備する目的で患者発生の中止後1ヶ月に完了とみなされます。
5年間の最後のサマリー·レポートは、患者発生/データ収集の開始後CBER 5年6ヵ月に提出される予定である。5年間のデータを確認した後、メルクとCBERは、米国の妊娠のレジストリに、さらにデータ収集を継続する必要性を議論するために満たします。CBERは、米国の妊娠レジストリを中止するいかなる決定についての最終的な承認を必要があります。
21 CFR 601.70の要件を報告の対象ではない市販後研究。
次のように我々は、2006年6月6日の提出で説明されている市販後臨床試験のコミットメントを認める。
あなたはすべての初期市販後、 "定期的な"有害事象の報告は、 "15日間のアラートレポートの下に覆われていない、定期的な報告(すなわちにさらされている受信CBERと同時に、システムをワクチン有害事象報告のためのFDAの請負業者(VAERS)を提供することを約束しています月次ベースで21 CFR 600.80)の下に "の要件。指定された月にメルク社が受信した最初の報告書は、翌月の10日目の作業でVAERSフォーム上のCBERへとVAERS請負業者に提出される。
また、21 CFR 600.80、VAERSの請負業者に対し、四半期ごとの定期的な有害事象報告書に基づき、提供することで合意しました。四半期ごとの有害事象報告書は、現在のレポート期間に提出されたすべての初期報告書の要約が含まれ、すべてが3ヶ月の期間中に収集されたVAERSフォームに情報をフォローアップが含まれます。
あなたは、CBERの免許の日付後の最初の3年間は、前述のプロセスを使用してこの情報を提供することにコミットしています。
次のように我々は、2006年6月2日のあなたの投稿で説明した市販後の品質のコミットメントを認める。
あなたは、要求された製品2006年7月31日、2〜8°Cで36ヶ月の貯蔵寿命をサポートするために、現在の安定性の研究に関するすべての最終的なコンテナロット(バイアル、シリンジの両方)上で使用可能なすべての安定性データを提供することをお約束しています。( - 2から8℃で数ヶ月の記憶)が利用可能になったこれらのロットの安定性データへの追加更新は、研究のエンドポイントを介して、送信されます。
我々は、この生物学的製剤のライセンスアプリケーション(BLA)、STN BL 125126へのクロスリファレンスの文字で、あなたのIND ----に臨床プロトコルを提出することを要求します。私達はあなたのBLA、STN BL 125126にn onclinical、化学、製造、およびコントロールのプロトコルおよびすべての研究最終報告書を提出することを要求します。目立つように、必要に応じてこれらの市販後調査のコミットメントに関連したサプリメントも含めて、すべての提出を、ラベルには、次の指定子を使用してください:
市販後調査プロトコル
市販後調査最終報告書
市販後調査の対応
市販後調査に関する年次報告書
21 CFR 601.70の報告要件に各市販後調査の対象では、この製品の市販後調査に関する年次報告書のステータスを記述する必要があります。それぞれの研究のためのステータスレポートは、含める必要があります。
市販のコミットメントを識別し、記述するための情報、
コミットメントの元のスケジュール、
コミットメントの状態(すなわち、保留、進行中の、遅延、終了、または提出)し、
対象発生率(すなわち、数値、日付、総計画登録に在籍)、臨床研究のためなど、ステータスの説明。
21 CFR 601.70(e)に記載されているように、我々は、公に当社Webサイト(http://www.fda.gov/cder/pmc/default.htm)にこれらの市販後調査に関する情報を開示する場合があります。
業界のためのFDAのガイダンスを参照してください:市販後調査のコミットメントの状況に関するレポート - 1997年の食品医薬品局近代化法のセクション130(2006年2月)の実施(http://www.fda.gov/cber/gdlnsを参照してください。詳細については、/ post130.htm)。
で説明されているように不利な経験ライセンスの生物学的製品の有害事象の報告要件に従って、レポート(21 CFR 600.80)、およびディストリビューション報告(21 CFR 600.81)を提出してください。21歳未満のCFR 600.80(c)は(2)[定期的な有害事象レポート]は、承認後の最初の3年間の四半期ごとの間隔で、このセクションのパラグラフ(c)(1)(ⅰ)の下で報告されていないそれぞれの有害事象を報告しなければなりません、そして毎年恒例の間隔で。
我々は、承認後最初の3年間の月次ベースで特定のレポートを提出する上記の項目7で臨床コミットメントに注意してください。お使いの製品がワクチンとして特徴づけされているので、事前に対処フォームVAERS-1を用いてワクチン有害事象報告システム(VAERS)にこれらのレポートを提出してください。
あなたは、21 CFR 600.14の下に生物学的製剤の逸脱の報告書を提出しなければなりません。あなたは、速やかに処理、テスト、ラベリング、包装、貯蔵、保有及び配布に関連付けられているものも含め、すべての製造偏差を識別し、調査する必要があります。偏差は分散の製品が含まれている場合は、安全性、純度、あるいは本製品の効力に影響を与え、規制の他の基準を満たしていることが、あなたはディレクター、コンプライアンスのOfficeと生物学的製剤の品質にフォームFDA-3486に関する報告書を提出しなければならない生物学的製剤評価研究センター、HFM-600、1401ロックビルパイク、ロックビル、MD 20852から1448。
FDAフォームの356hのすべての最終的な印刷ラベルと実装情報を送信してください。ラベルのPDF形式の電子版を提供してください。
さらに、生物学的製剤評価研究、広告や販促ラベル支店、HFM-602、1401ロックビルパイク、ロックビル、MDのセンターにFDAフォーム2253で提案された紹介広告や販促ラベルの2つのドラフトのコピーを提出したい場合があります20852から1448。最終的な印刷広告や販促ラベルの2つのコピーは、FDAフォーム2253に伴って、初期の普及の時に提出しなければなりません。
すべてのプロモーションの請求は、承認されたラベルに反すると一致していないなければなりません。あなたが私たちにこのような主張をサポートするためにデータを提出し、そのような主張のためにCBERの承認を受けた場合を除き、他の製品に比べ優位性の比較プロモーション請求または請求を行うべきではありません。
ご不明な点がございましたら、301-827-3070で博士プリゴパライチョードゥリーにお問い合わせください。
敬具、
ノーマン·W·ベイラー博士
監督
ワクチンのオフィス
研究とレビューの
生物学的製剤センター
評価研究
製品のページに戻る
英文テキスト
Vaccines, Blood & Biologics
Home Vaccines, Blood & Biologics Vaccines Approved Products
Vaccines
Approved Products
- June 8, 2006 Approval Letter - Human Papillomavirus Quadrivalent (Types 6, 11, 16, 18) Vaccine, Recombinant
DEPARTMENT OF HEALTH AND HUMAN SERVICES
Public Health Service
Food and Drug Administration
1401 Rockville Pike
Rockville, MD 20852-1448
June 8, 2006
Our STN: BL 125126/0
Merck & Co., Inc.
Attn: Dr. Patrick Brill-Edwards
Director
Worldwide Regulatory Affairs
Vaccines/Biologics
P.O. Box 4 , BLB-22
West Point , PA 19486-0004
Dear Dr. Brill-Edwards:
We have approved your biologics license application (BLA) for Quadrivalent Human Papillomavirus (Types 6, 11, 1 6, 18) Recombinant Vaccine effective this date. You are hereby authorized to introduce or deliver for introduction into interstate commerce, Quadrivalent Human Papillomavirus (Types 6, 11, 16, 18) Recombinant Vaccine under your existing Department of Health and Human Services U.S. License No. 0002. Quadrivalent Human Papillomavirus (Types 6, 11, 16, 18) Recombinant Vaccine is indicated for vaccination in females 9 to 26 years of age for prevention of the following diseases caused by Human Papillomavirus (HPV) Types 6, 11, 16, and 18:
Cervical cancer
Genital warts (condyloma acuminata)
and the following precancerous or dysplastic lesions:
Cervical adenocarcinoma in situ (AIS)
Cervical intraepithelial neoplasia (CIN) grade 2 and grade 3
Vulvar intraepithelial neoplasia (VIN) grade 2 and grade 3
Vaginal intraepithelial neoplasia (VaIN) grade 2 and grade 3
Cervical intraepithelial neoplasia (CIN) grade 1.
Under this authorization, you are approved to manufacture Quadrivalent Human Papillomavirus (Types 6, 11, 16, 18) Recombinant Vaccine at Merck & Co., Inc., West Point, PA. The final formulation and filling is performed by Merck & Co., Inc., West Point, PA. Labeling and packaging will be performed by Merck & Co., Inc., West Point, PA. You may label your product with the proprietary name GARDASIL®. The vaccine will be supplied as a 0.5 mL single-dose vial, a carton of ten 0.5 mL single dose vials, a 0.5 mL single-dose prefilled syringe and a carton of six 0.5 mL single-dose prefilled syringes. The prefilled syringes will be preassembled with Ultra Safe® Passive™ Needle Guard devices.
The dating period for GARDASIL® vaccine shall be 36 months from the date of manufacture of the final filled container when stored at 2 to 8 °C. The 36 month shelf life includes all of the time that the final filled container is held at 2 to 8 °C prior to packaging. The date of manufacture shall be defined as the start date of filling into final containers. ------------ -------------- ----------- ---------------- ----------------- --------- --------------- -------------- -------------- ----------------- -----------------
Please submit final bulk samples and final container samples of the product together with lot release protocols in electronic format showing results of all applicable tests. You may not distribute any lots of product until you receive a notification of release from the Director, Center for Biologics Evaluation and Research (CBER).
You must submit information to your BLA for our review and written approval under 21 CFR 601.12 for any changes in the manufacturing, testing, packaging or labeling of GARDASIL® vaccine, or in the manufacturing facilities.
Under the Pediatric Research Equity Act (PREA), all applications for new active ingredients, new dosage forms, new indications, new routes of administration, and new dosing regimens are required to contain an assessment of the safety and effectiveness of the product in pediatric patients unless this requirement is waived or deferred. We are deferring pediatric studies for GARDASIL® in girls less than 9 years of age and in boys and adolescent males less than 18 years of age.
Postmarketing Studies subject to reporting requirements of 21 CFR 601.70.
We acknowledge the postmarketing clinical commitments outlined in your submission of June 6, 2006, as follows:
You have committed to conduct a short-term safety surveillance study in a U.S. Managed Care Organization (MCO). The study will include approximately 44,000 vaccinated subjects who will be followed for 60 days for assessment of general short-term safety (i.e., emergency room visits, hospitalizations, and deaths). The subjects will also be followed for 6 months subsequent to vaccination for new autoimmune disorders, rheumatologic conditions, or thyroiditis. Also, a sufficient number of children 11-12 years of age will be studied to permit an analysis of safety outcomes. The final study protocol will be submitted by December 31, 2006. Patient accrual will be completed by December 31, 2008. The study will be completed by June 30, 2009. The final study report will be submitted by September 30, 2009.
You have committed to collaborate with the cancer registries in four countries in the Nordic Region ( Sweden, Norway, Iceland, and Denmark) to assess long-term outcomes following administration of GARDASI®. In this study, approximately 5,500 subjects enrolled in Protocol 015 (one half from the placebo group that will have been vaccinated shortly after approval) will be followed for a total of 14 years. Two major goals of this study are: 1) to assess the long-term effectiveness of GARDASIL® by evaluating biopsy specimens for presence of HPV 6/11/16/18-related incident breakthrough cases of CIN 2/3, AIS and cervical cancer, VIN 2/3 and vulvar cancer, and VaIN 2/3 and vaginal cancer; and 2) to assess whether administration of GARDASIL® will result in replacement of these diseases due to vaccine HPV types with diseases due to non-vaccine HPV types. This study is designed to accomplish these goals as discussed in the June 6, 2006, submission to your BLA. The final protocol for this study will be submitted by December 8, 2006. Patient accrual for this study was previously completed in the context of Protocol 015. This study will be completed by December 31, 2017, (14 years from initiation of the last patient enrolled in Protocol 015 in the four Nordic countries). The final study report will be submitted by December 31, 2018.
You have committed to conduct a study in collaboration with the Norwegian Government, if GARDASIL ® is approved in the European Union and the Government of Norway incorporates HPV vaccination into its national guidelines, to assess the impact of HPV vaccination on the following in Norway:
The long-term burden of HPV disease including the incidence of HPV 6/11/16/18-related cervical disease;
The long-term burden of HPV disease caused by types other than HPV 6/11/16/18;
The overall incidence of cervical HPV disease;
The incidence of HPV-related cancers and pre-cancers (CIN 2/3, AIS and cervical cancer; VIN 2/3 and vulvar cancer; and VaIN 2/3 and vaginal cancer);
The interaction between administration of GARDASIL ® and pregnancy outcomes, especially congenital anomalies, by linking the vaccination registry with the Medical Birth Registry.
The size and age range of the population studied will depend on the final vaccination guidelines implemented by the Norwegian Government. Although at this time no other governments in the Nordic region have committed to similar population studies, you will notify CBER of any other collaborations if they occur. The projected date of submission of the final study protocol is pending collaboration with the Norwegian Government as noted above. Patient accrual will be completed 6 years after study initiation. The study will be completed 7 years after study initiation. The final study report will be submitted 8 years after study initiation. In the event that approval of GARDASIL® does not occur in Norway, you will notify CBER and propose alternative approaches to obtain this information in a timely manner.
You have committed to submit final Clinical Study Reports (CSRs) for Protocols 013 and 015 when completed. As discussed, for these studies, an "all CIN 2/3, AIS or cervical cancer" analysis will evaluate the evidence for replacement of disease due to HPV types 16 and 18 with non-vaccine HPV types. Similar analyses will be done for VIN 2/3, VaIN 2/3, vulvar cancer and vaginal cancer. Protocol 013 was submitted in December 2001, and Protocol 015 was submitted in May 2002. Protocol 013 accrual was completed in March 2003, and Protocol 015 accrual was completed in May 2003. These analyses will be completed by April 30, 2007. The final reports for these studies (i.e., CSRs) to include the results of these analyses will be submitted by June 30, 2007.
You have committed to provide data concerning duration of immunity following administration of GARDASIL® as follows from the studies noted:
The Nordic Long-Term Follow-up Study:
Interim reports of effectiveness (i.e., incident breakthrough cases of CIN 2/3, AIS and cervical cancer; VIN 2/3 and vulvar cancer; and VaIN 2/3 and vaginal cancer) and immunogenicity results will be submitted in 2009, 2011, 2013, and 2015. The final study report will be submitted by December 31, 2018.
Protocol 018 (Adolescent Sentinel Cohort):
Periodic reports beginning with Month 24 immunogenicity and long-term safety data will be submitted starting no later than March 30, 2007.
Publication of one year Post-dose 3 data will be submitted by January 30, 2007.
A Biologics License Supplement (BLS) for 1.5 year Post-dose 3 data will be submitted by June 30, 2007.
A Biologics License Supplement (BLS) for 2.5 year Post-dose 3 data will be submitted by December 31, 2007.
A Biologics License Supplement (BLS) for 5.5 year Post-dose 3 data will be submitted by December 31, 2010.
Protocol 007:
Publication of five-year immunogenicity data will be submitted by December 31, 2006.
Protocol 005:
Publication of seven and one half year immunogenicity data will be submitted by December 31, 2007.
You have agreed to establish a pregnancy registry in the U.S. to prospectively collect data on spontaneously-reported exposures to GARDASIL® during pregnancy. You have committed to submit a protocol for the U.S. pregnancy registry by July 20, 2006. You have agreed to address elements found in FDA's Guidance for Industry on Establishing Pregnancy Exposure Registries (9/2/2002) (http://www.fda.gov/cber/gdlns/pregexp.htm), as well as relevant Company Standard Operating Procedures. Furthermore, you have stated that you will notify CBER of significant deviations from this guidance and/or specify the deviations in the protocol. Patient accrual/data collection will begin at time of CBER's approval of the protocol and end five years later. You will submit annual reports and a final summary report of the U.S. pregnancy registry's findings five years after initiation of patient accrual/data collection. The U.S. pregnancy database will be considered completed one month after discontinuation of patient accrual for the purpose of preparing a five-year final summary report. The five-year final summary report will be submitted to CBER five years and six months after initiation of patient accrual/data collection. After reviewing the five-year data, Merck and CBER will meet to discuss the need to continue further data collection in the U.S. pregnancy registry. CBER will have final approval regarding any decision to discontinue the U.S. pregnancy registry.
Postmarketing Studies not subject to reporting requirements of 21 CFR 601.70.
We acknowledge the postmarketing clinical commitment outlined in your submission of June 6, 2006, as follows:
You have committed to provide CBER and simultaneously the FDA contractor for the Vaccine Adverse Events Reporting System (VAERS) all initial postmarketing "periodic" adverse experience reports received that are subject to periodic reporting (i.e., not covered under the "15-day Alert report" requirement under 21 CFR 600.80) on a monthly basis. Initial reports received by Merck in a given month will be submitted on VAERS forms to CBER and to the VAERS contractor by Working Day 10 of the following month. You have also agreed to provide, in accordance with 21 CFR 600.80, the Quarterly Periodic Adverse Experience Report to the VAERS contractor. The Quarterly Adverse Experience Report will contain a recapitulation of all initial reports submitted for the current reporting period and will include all follow up information on VAERS forms collected during that three-month period. You have committed to providing CBER this information using the aforementioned process, for the first three years after the date of licensure.
We acknowledge the postmarketing quality commitments outlined in your submission of June 2, 2006, as follows:
You have committed to providing all available stability data on all final container lots (both vials and syringes) currently on stability study to support the requested product shelf-life of 36 months at 2 to 8 °C by July 31, 2006. Additional updates to the stability data for these lots will be submitted as they become available, through the study endpoint (-- months storage at 2 to 8 °C).
We request that you submit clinical protocols to your IND ----, with a cross-reference letter to this biologics license application (BLA), STN BL 125126. We request that you submit n onclinical and chemistry, manufacturing, and controls protocols and all study final reports to your BLA, STN BL 125126. Please use the following designators to prominently label all submissions, including supplements, relating to these postmarketing study commitments, as appropriate:
Postmarketing Study Protocol
Postmarketing Study Final Report
Postmarketing Study Correspondence
Annual Report on Postmarketing Studies
For each postmarketing study subject to the reporting requirements of 21 CFR 601.70, you must describe the status in an annual report on postmarketing studies for this product. The status report for each study should include:
information to identify and describe the postmarketing commitment,
the original schedule for the commitment,
the status of the commitment (i.e., pending, ongoing, delayed, terminated, or submitted), and
an explanation of the status including, for clinical studies, the subject accrual rate (i.e., number enrolled to date and the total planned enrollment).
As described in 21 CFR 601.70(e), we may publicly disclose information regarding these postmarketing studies on our Web site (http://www.fda.gov/cder/pmc/default.htm). Please refer to FDA's Guidance for Industry: Reports on the Status of Postmarketing Study Commitments - Implementation of Section 130 of the Food and Drug Administration Modernization Act of 1997 (February 2006) (see http://www.fda.gov/cber/gdlns/post130.htm) for further information.
Please submit adverse experience reports in accordance with the adverse experience reporting requirements for licensed biological products (21 CFR 600.80), and distribution reports as described in (21 CFR 600.81). Under 21 CFR 600.80(c) (2) [Periodic Adverse Experience Reports], you must report each adverse experience not reported under paragraph (c) (1) (i) of this section at quarterly intervals for the first 3 years following approval, and then at annual intervals. We note your clinical commitment in item 7 above to submit certain reports on a monthly basis for the first three years following approval. Since your product is characterized as a vaccine, submit these reports to the Vaccine Adverse Event Reporting System (VAERS) using the pre-addressed form VAERS-1.
You must submit reports of biological product deviations under 21 CFR 600.14. You should promptly identify and investigate all manufacturing deviations, including those associated with processing, testing, packing, labeling, storage, holding and distribution. If the deviation involves a distributed product, may affect the safety, purity, or potency of the product, and meets the other criteria in the regulation, you must submit a report on Form FDA-3486 to the Director, Office of Compliance and Biologics Quality, Center for Biologics Evaluation and Research, HFM-600, 1401 Rockville Pike, Rockville, MD 20852-1448.
Please submit all final printed labeling and implementation information on FDA Form 356h. Please provide a PDF-format electronic version of the label.
In addition, you may wish to submit two draft copies of the proposed introductory advertising and promotional labeling with an FDA Form 2253 to the Center for Biologics Evaluation and Research, Advertising and Promotional Labeling Branch, HFM-602, 1401 Rockville Pike, Rockville, MD 20852-1448. Two copies of final printed advertising and promotional labeling should be submitted at the time of initial dissemination, accompanied by a FDA Form 2253. All promotional claims must be consistent with and not contrary to approved labeling. You should not make a comparative promotional claim or claim of superiority over other products unless you have submitted data to support such claims to us and received CBER approval for such claims.
If you have any questions, please contact Dr. Gopa Raychaudhuri at 301-827-3070.
Sincerely yours,
Norman W. Baylor, Ph.D.
Director
Office of Vaccines
Research and Review
Center for Biologics
Evaluation and Research
Return to product page
- Page Last Updated: 04/30/2009
Note: If you need help accessing information in different file formats, see Instructions for Downloading Viewers and Players.